De UDI-richtlijn voor medische hulpmiddelen
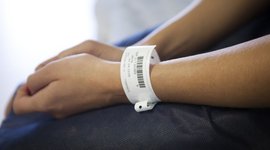
In de toekomst moet elk medisch hulpmiddel duidelijk voorzien zijn van een etiket en dus wereldwijd identificeerbaar zijn. Dit wordt gedaan met behulp van Unique Device Identification, kortweg UDI. Op Europees niveau wordt de invoering van deze etikettering geregeld door de regelgeving betreffende medische hulpmiddelen (Medical Device Regulation, MDR). Dit is al in 2017 ingevoerd en wordt nu geleidelijk aan van kracht. Voor de invoering en uitvoering van de regels wordt een risicogebaseerde aanpak gehanteerd, d.w.z. dat producten van risicoklasse III als eerste moeten worden voorzien van een etiket en producten van klasse I als laatste. Dit om de veiligheid van de patiënt en de traceerbaarheid van medische hulpmiddelen beter te kunnen garanderen. Daartoe krijgt elk product een productidentificatie in de vorm van een numerieke code en een streepjes- of 2D-code. Het idee hierachter: De numerieke code is leesbaar door mensen, de streepjescode machinaal. Als het product erg klein is, volstaat ook de scanbare code. De UDI-vereisten vormen nu een belangrijk onderdeel van de conformiteitsbeoordeling om de CE-markering te verkrijgen.
Onderdelen van het UDI-etiketteringssysteem
Het UDI-systeem bestaat uit een unieke identificatie van het product, de verpakkingsniveaus en de bijbehorende gegevens. Dit verhoogt de wereldwijde traceerbaarheid en identificatie van producten. Dit zorgt voor meer transparantie op de markt en een snellere verwerking van corrigerende maatregelen of terugroepacties, met inbegrip van kennisgevingen van regelgevende instanties.
UDI-DI & UDI-PI
De UDI bestaat uit twee delen: de product identificatiecode (UDI-DI) en de productie-identificatiecode (UDI-PI).
De eerste (UDI-DI) dient ter identificatie van het product en de fabrikant en moet op het product zelf en bovendien op de verpakking worden aangebracht. Het wordt toegewezen door de verantwoordelijke toewijzende instantie en is statisch. Het bevat maximaal 20 gegevens, zoals informatie over de handelsnaam, de herbruikbaarheid, de steriliteit, enz. De laatste (UDI-PI) wordt toegekend door de bevoegde toewijzende instantie en geeft de partij van een product aan, b.v. partij- of batchnummers, serienummers, verval- en/of fabricagedata en wordt door de fabrikant zelf toegekend.
Basis UDI-DI
De basis-UDI-DI heeft een bijzondere rol. Deze identificeert soortgelijke producten met hetzelfde gebruiksdoel en dezelfde risicoklasse die enigszins van elkaar verschillen, bijvoorbeeld in motorvermogen. Dit maakt het tot een soort modelidentificatie. Hoewel de UDI-DI als een sleutel voor de UDI-databank EUDAMED fungeert, staat deze nog steeds niet op het product of de verpakking, maar wordt het door de fabrikanten samen met andere gegevenselementen in de UDI-databank gespecificeerd. Fabrikanten moeten ook een lijst bijhouden van alle toegewezen UDI's voor elk medisch hulpmiddel. Dit is onderdeel van de technische documentatie.
UDI op verpakkingen
Voorts moeten fabrikanten van medische hulpmiddelen vanaf 2021 niet alleen de producten zelf (afhankelijk van de klasse van het medische hulpmiddel), maar ook hun verpakking (uitzondering: containers) achtereenvolgens van de UDI voorzien. Hier geldt: de code moet gedurende de gehele levensduur leesbaar blijven. Dit geldt voor alle medische hulpmiddelen.
UDI-etikettering: belangrijke wettelijke vereiste, maar gaat gepaard met extra kosten
Met de UDI-richtlijn zet de EU een grote stap voorwaarts op het gebied van de veiligheid voor patiënten in de medische en farmaceutische sector door middel van duidelijke etikettering en volledige traceerbaarheid. Niettemin zijn de hindernissen voor de betrokken fabrikanten niet zonder moeilijkheden en de tenuitvoerlegging kan nauwelijks worden beheerst zonder deskundig advies en een ervaren partner. Onze deskundigen zullen u dan ook graag helpen bij al uw vragen en zorgen over etikettering met de UDI.