Etiket voor medische hulpmiddelen
Implementatie van de bindende UDI-richtlijnen, integratie van veiligheidskenmerken voor een absoluut tegen namaak beveiligde productbeveiliging of opvolgende nummering om wereldwijde traceerbaarheid te garanderen - met onze oplossingen voor de etikettering van medische hulpmiddelen speelt u op zeker. En niet alleen met betrekking tot de toepasselijke EU-richtlijnen, maar ook op het gebied van transparantie en volledige traceerbaarheid.
HET INOTEC VOORDEEL
- Etiketteringsoplossingen individueel aangepast aan uw omstandigheden
- Duidelijke etikettering voor de implementatie van geldende richtlijnen
- Anti-vervalsingsetiketten voor maximale productbescherming
- Serialisatie voor gegarandeerde uitsluiting van dubbele nummers en eenvoudige traceerbaarheid - zelfs wereldwijd
- Cloud-gebaseerde track & trace softwareverbinding mogelijk: voor eenvoudige toegang vanaf verschillende eindapparaten
- Naadloze traceerbaarheid van alle medische hulpmiddelen in realtime
- Op verzoek: productbeschermingslabels in uw eigen ontwerp
- Advies, allround service en langdurige ondersteuning van onze experts
Assetbeheer en Track & Trace in de medische sector
Niets gaat hier verloren!

Altijd weten hoe het staat met de huidige voorraad en waar uw producten zich bevinden – met cloudgebaseerde Track & Trace-oplossingen is dit geen probleem. Hiermee kunt u de locatie van uw medische producten in real-time volgen. Dankzij onze geserialiseerde barcode- en RFID-oplossingen behoren onzekerheden en ongewenste verrassingen tot het verleden. In plaats daarvan kunt u precies volgen waar uw apparaten in gebruik zijn. Zo kunt u zowel tekorten voorkomen als onnodige investeringen vermijden. Vooral grotere laboratoria, ziekenhuizen of ziekenhuisnetwerken profiteren van deze transparantie van het inventaris.
Productbescherming voor medische en farmaceutische producten
Voor de zekerheid

Afbeeldingsschade en levensbedreigende gevolgen voor patiënten door onbewust gebruik van vervalste producten zijn een groeiend probleem – vooral omdat het steeds moeilijker wordt om vervalsingen te herkennen. Met de productbeschermingsoplossingen van inotec, zoals bijvoorbeeld inoVerify, kunt u uw klanten nu de veiligheid garanderen die ze verdienen. Van verschillende open of verborgen beveiligingskenmerken tot manipulatiebestendige etiketten en serialisatie met wereldwijde traceerbaarheid – bij inotec krijgt u absolute productbescherming, op maat gemaakt voor uw behoeften. En natuurlijk in uw eigen ontwerp.
De UDI-richtlijn voor medische producten
Wanneer duidelijke identificatie verplicht wordt

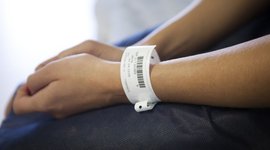
In de toekomst moet elk medisch product duidelijk gelabeld zijn en wereldwijd identificeerbaar worden. Dit gebeurt met behulp van de Unique Device Identification (UDI). Op Europees niveau wordt de invoering van deze labeling geregeld door de Medical Device Regulation (MDR). Deze werd al in 2017 geïntroduceerd en treedt nu geleidelijk in werking. Voor de invoering en implementatie hanteert de verordening een risicogebaseerde benadering, wat betekent dat producten van risicoklasse III eerst geëtiketteerd moeten worden, en producten van klasse I (tot 2027) als laatste. Dit moet de veiligheid van patiënten verbeteren en de terug- en opvolgbaarheid van medische producten beter waarborgen. Elk product krijgt een productidentificatie in de vorm van een numerieke code en een streep- of 2D-code. Het idee hierachter is dat de numerieke code leesbaar is voor mensen, terwijl de streep- of 2D-code door machines kan worden gelezen. Als het product zeer klein is, is ook de machineleesbare code voldoende. De UDI-vereisten zijn nu een belangrijk onderdeel van de conformiteitsbeoordeling voor het verkrijgen van de CE-markering.
Bestanddelen van de UDI-markering
UDI-DI & UDI-PI
De UDI bestaat uit twee delen: de product identificatiecode (UDI-DI) en de productie-identificatiecode (UDI-PI).
De eerste (UDI-DI) dient ter identificatie van het product en de fabrikant en moet op het product zelf en bovendien op de verpakking worden aangebracht. Het wordt toegewezen door de verantwoordelijke toewijzende instantie en is statisch. Het bevat maximaal 20 gegevens, zoals informatie over de handelsnaam, de herbruikbaarheid, de steriliteit, enz. De laatste (UDI-PI) wordt toegekend door de bevoegde toewijzende instantie en geeft de partij van een product aan, b.v. partij- of batchnummers, serienummers, verval- en/of fabricagedata en wordt door de fabrikant zelf toegekend.
Basis UDI-DI
De basis-UDI-DI heeft een bijzondere rol. Deze identificeert soortgelijke producten met hetzelfde gebruiksdoel en dezelfde risicoklasse die enigszins van elkaar verschillen, bijvoorbeeld in motorvermogen. Dit maakt het tot een soort modelidentificatie. Hoewel de UDI-DI als een sleutel voor de UDI-databank EUDAMED fungeert, staat deze nog steeds niet op het product of de verpakking, maar wordt het door de fabrikanten samen met andere gegevenselementen in de UDI-databank gespecificeerd. Fabrikanten moeten ook een lijst bijhouden van alle toegewezen UDI's voor elk medisch hulpmiddel. Dit is onderdeel van de technische documentatie.
UDI op verpakkingen
Voorts moeten fabrikanten van medische hulpmiddelen vanaf 2021 niet alleen de producten zelf (afhankelijk van de klasse van het medische hulpmiddel), maar ook hun verpakking (uitzondering: containers) achtereenvolgens van de UDI voorzien. Hier geldt: de code moet gedurende de gehele levensduur leesbaar blijven. Dit geldt voor alle medische hulpmiddelen.
UDI-etikettering: belangrijke wettelijke vereiste, maar gaat gepaard met extra kosten
Met de UDI-richtlijn zet de EU een grote stap voorwaarts op het gebied van de veiligheid voor patiënten in de medische en farmaceutische sector door middel van duidelijke etikettering en volledige traceerbaarheid. Niettemin zijn de hindernissen voor de betrokken fabrikanten niet zonder moeilijkheden en de tenuitvoerlegging kan nauwelijks worden beheerst zonder deskundig advies en een ervaren partner. Onze deskundigen zullen u dan ook graag helpen bij al uw vragen en zorgen over etikettering met de UDI.